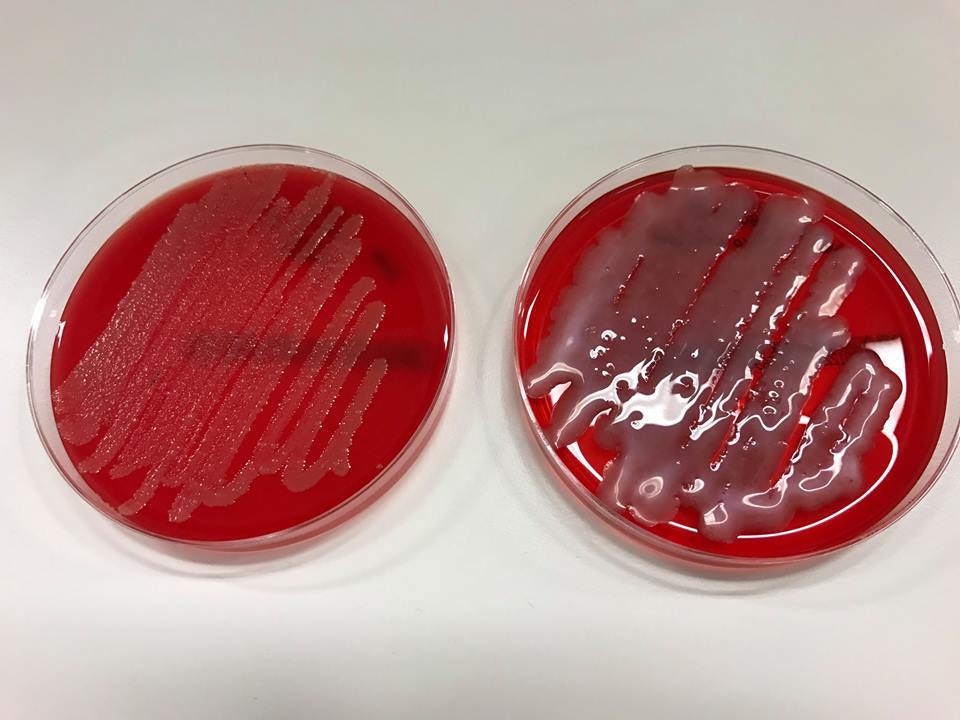
Ogni anno, muoiono in tutto il mondo da infezioni antibiotico-resistenti circa 700.000 persone. Nel 2050 questo numero potrebbe saltare a 10 milioni.
Una volta tutti gli antibiotici erano di origine naturale. L’epoca antibiotica, comincia nel 1928 nel laboratorio di Sir Alexander Fleming, a Londra, dove c’era sempre una finestra socchiusa per lasciar passare un po’ di ossigeno. Dopo alcune settimane le coltivazione di alcuni funghi, i Penicillium, esposti alla leggera brezza londinese, che filtrava nel laboratorio di Fleming, produssero una muffa, che venuta a contatto casualmente con il batterio Staphylococcus, lo distrusse. Quella muffa, lavorata artigianalmente da Flemming, sarà il primo antibiotico della storia, chiamato appunto Penicillina in virtù dei funghi da cui era stata prodotta.
Fu poi la volta del Cloramfenicolo, prodotto da un batterio trovato nel compost in Venezuela e dalla Clorotraciclina, escreto da un batterio trovato in un campo presso l’Università del Missouri, durante un test di coltivazione del fieno.
Questi erano i farmaci principali dell’epoca antibiotica, che avevano trasformato le storiche pandemie in un fastidioso inconveniente. La loro capacità di uccidere i batteri, a cui si devono le principali malattie dell’Ancien Regime, non era una proprietà accidentale. I primi antibiotici erano versioni raffinate di armi biochimiche che i batteri avevano sviluppato in migliaia di anni, competendo con altri microrganismi per assicurarsi lo spazio vitale, il nutrimento e la possibilità di riprodursi. Questi organismi sembrava prosperassero solo in luoghi umidi e sporchi.
Questi primi antibiotici furono fonte di guadagni così redditizi che i produttori iniziarono a “ripulire” il mondo per averne di aggiuntivi.
Bristol-Myers (ora Bristol-Myers Squibb) nella busta della sua relazione annuale del 1951, in una nota, chiedeva ai suoi azionisti di Raccogliere “un cucchiaino di terreno, leggermente umido, ma non bagnato e privo di grosse pietre”, e di spedirlo alla sede dello stabilimento.
Eli Lilly concluse un accordo con i membri dell’Alleanza cristiana e missionaria, nel quale, ai ministri che si apprestavano a girare il mondo in via di sviluppo venissero assegnati dei tubi “provetta” da portarsi dietro per raccogliere campioni.
Pfizer reclutava esploratori, piloti e corrispondenti stranieri perché gli inviassero campioni di terreno.
Le ricerche che hanno portato agli antibiotici sono state cruciali:
– l’Eritromicina, dalle Filippine;
– la Vancomicina, dal suolo della giungla nel Borneo;
– Daptomicina, dalle colline del monte Ararat.
Il lavoro di identificazione e isolamento di composti utili fu però molto lento:
– Selman Waksman, un microbiologo finanziato da Merck, elaborò 10.000 campioni prima di identificare la Streptomicina;
– Pfizer esaminò più di 130.000 campioni prima di trovare la Terramicina, una tetraciclina precoce.
Un cucchiaino da tè può contenere milioni di microrganismi – tuttavia solo un sottoinsieme di essi può dare composti utili come antibiotici. E all’interno di quel sottoinsieme, solo un piccolo frammento crescerà in un laboratorio, lontano dai complessi ambienti naturali in cui si è evoluto.
I ricercatori che pensavano di accedere a un intero nuovo universo di cure – e di profitti – si trovarono bloccati.
Gli scopritori della Terramicina dichiararono, nel 1951, al New Yorker che, prima di trovarla, avevano riscoperto la Streptomicina “almeno cento volte”.
Alla fine degli anni Sessanta le aziende farmaceutiche avevano rinunciato a ricercare antibiotici nel terreno e si erano, invece, orientati a sintetizzarli in laboratorio. Il tasso di ricerca di nuovi farmaci è così diminuito. Dal 1940 al 1970, una dozzina di diverse classi di antibiotici hanno ottenuto, attraverso test clinici, il rilascio sul mercato americano. Dal 1970 in poi, solo alcune nuove classi hanno ottenuto il via libera all’utilizzo clinico, il che significa che quasi tutti i nuovi antibiotici, prodotti da allora in poi, sono state varianti di quelli già esistenti e basati su meccanismi che i batteri hanno ormai imparato a sconfiggere.
Senza nuove medicine per contrastare la diffusione dei batteri si ritorna al pericolo di malattie ormai da tempo dimenticate.
Il MRSA, resistente a molti farmaci, saltò fuori dagli ospedali a metà degli anni ’90, allontanando gli atleti e creando casi di polmonite di rapida diffusione che possono uccidere un bambino in pochi giorni.
I primi anni 2000 portarono alla diffusione di VRE, che provoca gravi infezioni ospedaliere ed è resistente alla Vankomicina, un farmaco recente.
Il NDM, un gene resistente a una famiglia di farmaci chiamata Carbapenems, è stato trasportato fuori dall’India verso tutto il mondo, direttamente dai viaggiatori infetti alla fine degli anni 2000.
Un altro gene resistente, l’MCR, che disattiva il Colistino, un antibiotico molto recente (come la Vancomicina, sul mercato fin dagli anni ’50), è stato identificato in Cina nel 2015 e da allora si è manifestato in più di 30 paesi in tutto il mondo.
La crescente marea pluriresistente ai farmaci ha attirato l’attenzione delle Nazioni Unite, che hanno convocato, in un incontro speciale, i governi di tutto il mondo, e in cui hanno raccomandato di evitare abusi nella prescrizione di antibiotici e di sostenere, invece, la ricerca finalizzata a trovare nuovi farmaci.
Ban Ki-moon, allora segretario generale, dichiarava che si trattava di “una minaccia fondamentale a lungo termine per la salute umana”.
Attraverso una campagna di crowding e una pagina Facebook viene lanciata una campagna simile a quella degli anni Cinquanta, destinata a raccogliere un’ampia gamma di campioni provenienti da tutto il mondo, dal microbiologo Adam Roberts dell’Università di Londra, che per più di un decennio aveva studiato uno dei principali modi in cui batteri divengono resistenti agli antibiotici ovvero passando geni avanti e indietro con segmenti di DNA usati quali vettori di scambio.

https://www.facebook.com/swabandsend/
La “resistenza trasmissibile”, così chiamata, fu descritta già negli anni ’60 da due ricercatori giapponesi che avevano notato che i ceppi del batterio originale alimentare Shigella erano diventati resistenti a farmaci che i pazienti contagiati non avevano mai utilizzato.
Da sempre un incubo microbiologico, la “resistenza trasmissibile” permette che le mutazioni che conferiscano la protezione contro gli antibiotici si diffondano non solo in modo ereditario, dalla cellula madre a quella figlia, ma anche tra batteri non correlati attraverso lo scambio di plasmidi, piccoli segmenti di DNA che esistono separati dai cromosomi. I plasmidi possono trasportare contemporaneamente più geni, in modo da permettere la resistenza a più farmaci e istallarsi in batteri che a quel punto ne dispongono come un mazzo di carte jolly da giocarsi diversamente secondo le occasioni. Roberts, affascinato da questo fenomeno per anni, decide, però di spostare la sua attenzione in un’altra direzione: “Cominciai a pensare che potevamo andare avanti per sempre a trovare nuovi geni di “resistenza”, perché sono sempre in evoluzione. Ma invece di cercare nuovi geni, perché non cercare nuovi farmaci?”
Riparte allora da dove la chimica farmaceutica si era fermata decenni prima: nelle situazioni caotiche del mondo reale da cui i batteri fuoriescono.
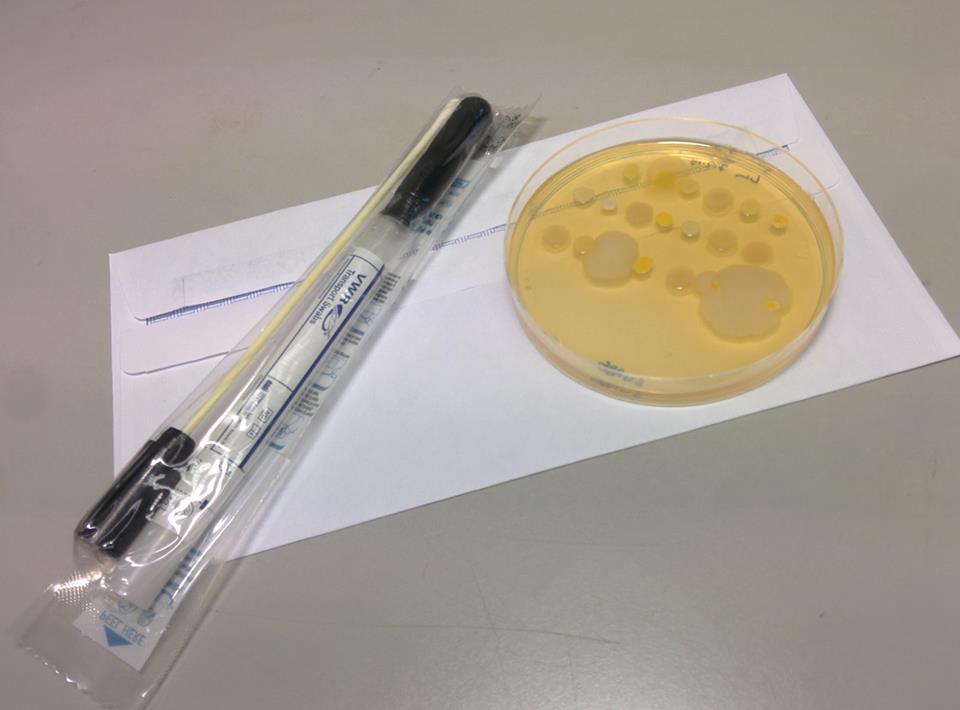
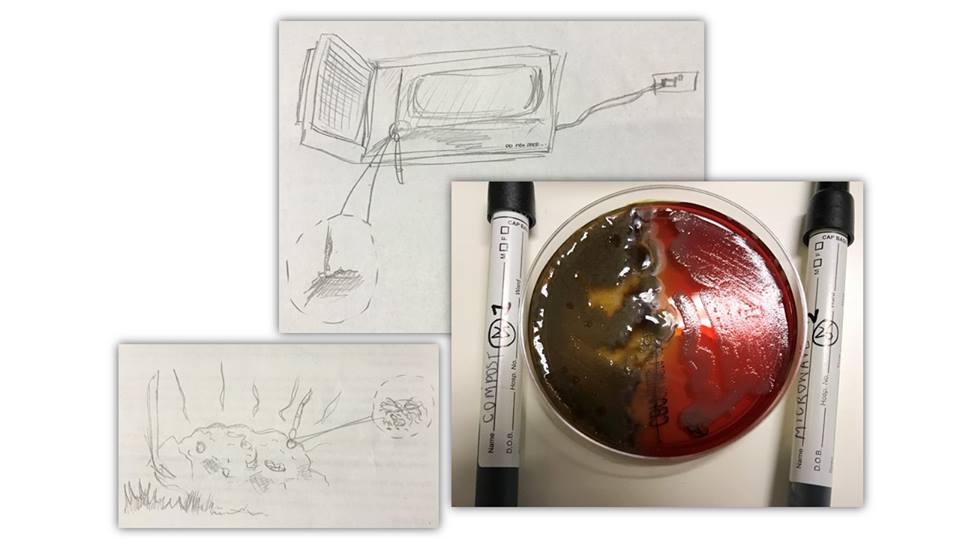
Lanciata la sua campagna, denominata “Swab and Send”, nel febbraio 2015. Per 5 sterline, invia ai partecipanti un tubo per i campionamenti, una busta di spedizione e una spiegazione di ciò che si sta ricercando e come si può essere di aiuto, ovvero usando un po’ di immaginazione, il meno scientifico-sanitaria possibile, ipotizzare luoghi in cui si potrebbero raccogliere più batteri in competizione per il cibo e la riproduzione.
Nelle prime ricerche antibiotiche, ci si concentrava sul suolo. Roberts chiede, invece, ai suoi partecipanti di cercare in luoghi che i suoi predecessori potevano aver trascurato: “C’è un ricco ambiente microbico ovunque intorno a noi. Ogni singolo luogo è una nicchia in cui i batteri si sarebbero evoluti e adattati in modo indipendente. Il suolo può aver dato il via a una guerra biologica completamente diversa da un ambiente marino o da un ambiente fangoso o dall’acqua stagnante contaminata. C’è una possibilità biochimica diversa ovunque”. La campagna “Swab and Send” ha catturato l’entusiasmo della gente e nel giro di due mesi, Roberts ha ricevuto più di 1.000 sterline e centinaia di “tamponi” e molti ne continuano ad arrivare per posta. (Il costo per partecipare è salito, a 30 sterline per ricevere cinque tubi porta tampone). Le scuole elementari continuano ad invitare Roberts a fare delle presentazioni, in cui si distribuiscono ai ragazzi i tamponi da portare a casa. Alcuni tubi di campionamento arrivano addirittura da feste o direttamente dalla polvere rimossa dalle scrivanie del Parlamento.
https://www.youtube.com/watch?v=o3oDpCb7VqI
Roberts sta incubando e trasferendo campioni di qualunque batterio siano cresciuto nelle colture del suo laboratorio, ripetendo il processo che seguivano gli scienziati del 1940 per vedere cosa si può fare. Il primo passo è trasferire il tampone su un terreno di coltura e lasciarlo incubare. Il secondo è quello di separare tutti i batteri che crescono sul gel – perché il tampone può aver raccolto molte specie – quindi coprirle in singoli pozzetti su un piattino nuovo, permettendo loro di moltiplicarsi senza interferire gli uni con gli altri. Il terzo passo, e metterli in competizione in un altro terreno per vedere quali sono i più forti. Si sta ricercando una “zona di inibizione”, attorno a un batterio, che indica che quello è in grado di produrre un composto che può uccidere. Un batterio in grado di rimuovere un “ostacolo”, un batterio “superiore” che resista, per esempio, contro un ceppo di Eschiriacoli, a sua volta resistente a 15 farmaci diversi.
Se il batterio sopravvive a questa sfida, il composto che produce è considerato degno di ulteriore esame. Roberts utilizza strumenti analitici che non esistevano negli anni ’40 per scoprire se il sopravvissuto è veramente qualcosa di nuovo.
Robert e suoi studenti hanno, così, costretto migliaia di campioni di batteri, attraverso successivi cicli di incubazione ha secernere centinaia di composti che hanno ucciso, ciascuno, almeno un batterio di prova, e alcuni hanno ucciso un fungo-potenzialmente prezioso, perché i farmaci antifungini sono ancora più rapidi di quelli antibiotici. Finora, ha trovato 18 batteri promettenti, che hanno ucciso Escheriacoli multi-resistente. Il lavoro è lento, rispetto al ritmo dell’evoluzione batterica e questo naturalmente preoccupa Roberts, perché sà il rischio che la “resistenza” pone. Tre anni fa, sua figlia, che aveva 6 anni, giocando in campagna si era graffiata la gamba. Il graffio si trasformò in una pustola rossa che cominciò a diffondersi su e giù. I medici provarono tre diversi tipi di antibiotici, ma nessuno funzionò. Nell’arco di 12 ore dal suo arrivo all’ospedale era già stata portata in chirurgia. La figlia venne salvata, anche se le è rimasto un segno dove l’infezione è stata rimossa. Ma per Roberts l’episodio ha dimostrato che la “resistenza antibiotica” è imprevedibile e che la distanza tra un’infezione recalcitrante isolata e futuro prossimo meno resistente al contagio non è poi così lontano e che diventa importante cercare di prevenirlo: se il sistema sanitario non avesse potuto combattere l’infezione, sostenendone anche il costo economico, la figlia di Roberts avrebbe potuto perdere la gamba: “Se il sistema sanitario non avrà validi antibiotici imploderà”.
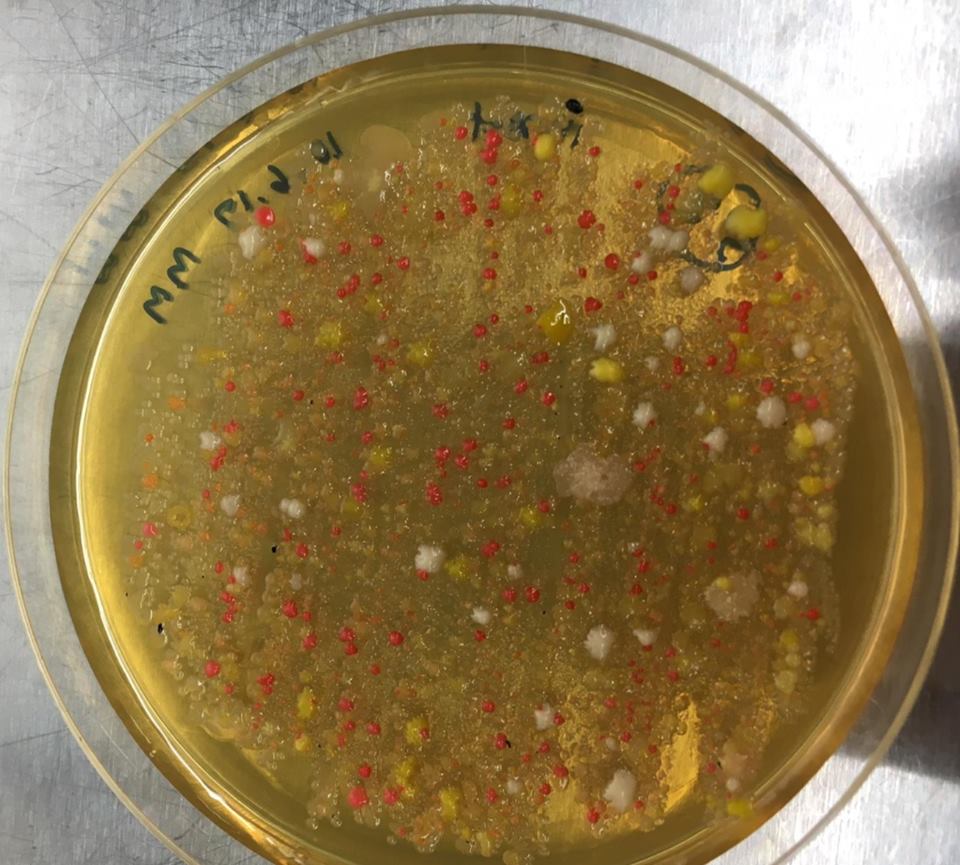
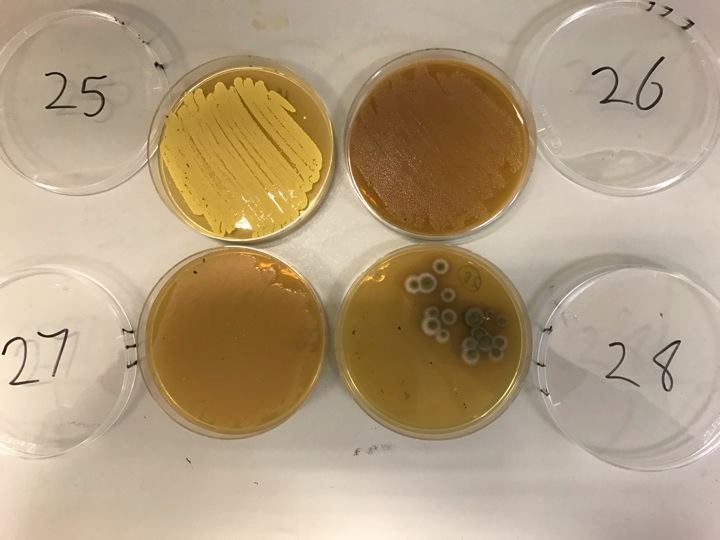
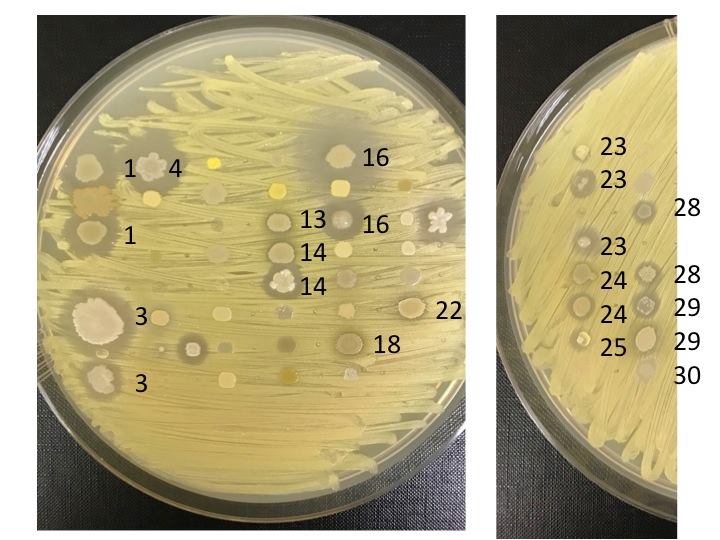
Lo si può verificare molto facilmente. Roberts, finora, ha trovato 18 batteri in grado di uccidere un ceppo di E. coli resistente a 15 diversi farmaci. La lentezza del metodo di ricerca di Roberts indica l’enormità della sfida che implica trovare nuovi antibiotici: “La cosa difficile non è trovare cose che uccidano i batteri come vapore, fuoco o candeggina”, spiega John Rex, che ha guidato lo sviluppo di antibiotici clinici presso Astra Zeneca e che ora è il responsabile medico della F2G, un’impresa che lavora su nuovi farmaci antifungini. “La sfida è trovare cose che uccidono i batteri, ma non nuociono alle persone che li assumono. Stiamo parlando di una sostanza chimica che va nella tua bocca, nel tuo intestino, nel tuo sangue, invariata, e che finisce dove c’è l’infezione e che uccide i batteri, senza intossicare te”.
Gli antibiotici potrebbero essere adattati a queste sfide, ma poichè gli antibiotici sono caduti all’insegna della “resistenza”, gli studiosi si stanno riorientando verso fonti naturali. “Ci siamo avvicinati al mondo naturale per testarne le potenzialità”, ha dichiarato Gerry Wright, direttore dell’Istituto Michael G. DeGroote per la ricerca sulle malattie infettive, presso la McMaster University in Ontario e co-fondatore del laboratorio High Screening Lab, un laboratorio che può automatizzare la sperimentazione dei composti. Nel tempo in cui Roberts e la sua squadra di ricercatori riescono a fare solo alcune dozzine di prove, un laboratorio come quello Wright ne può eseguire decine di migliaia: “Una tipica Streptomyces del suolo è geneticamente programmata per produrre da 20 a 40 composti diversi”, dice Wright. “Ma ognuno di questi composti richiede un’attività biologica. Non tutti i composti prodotti sono antibiotici, naturalmente, ma sono frutto dell’evoluzione. Non sono ottenuti dal nulla come le 20 o 40 sostanze chimiche casuali sintetizzate da un chimico, sareste fortunati se uno o due di queste fossero in grado di dar esito a un’attività biologica.
Oggi Roberts non è l’unico a guardare al mondo naturale per nuovi antibiotici. Una squadra dell’Università Northeastern ha inventato un dispositivo chiamato iChip, che consente di coltivare i batteri che non crescono nelle colture di laboratorio; il suo utilizzo ha portato all’isolamento di un composto promettente, la Teixobactina, ancora in fase di studio e a un progetto chiamato Small World Initiative, creato nel 2012 da Jo Handelsman, un professore dell’università del Wisconsin, già direttore associato dell’amministrazione Obama per la scienza, che è simile alla campagna di Roberts, ma con maggiore enfasi sull’istruzione.
Handelsman insegna ogni anno microbiologia di base a migliaia di studenti delle scuole superiori e universitari, facendo loro raccogliere campioni di terreno, isolare i batteri che i campioni contengono, testarli per l’attività antibiotica e poi far presentare la loro ricerca in un simposio. L’obiettivo è quello di trovare nuovi composti che le aziende o i ricercatori accademici potrebbero poi adottare nelle fasi successive. Anche se questi sforzi hanno successo, non è chiaro come un nuovo antibiotico possa poi raggiungere il mercato.
Le fasi successive dello sviluppo farmacologico – le prove cliniche, in più step, che comprovano la sicurezza e l’efficacia di un nuovo antibiotico su migliaia di pazienti – richiedono un livello di finanziamento di cui dispongono solo le grandi aziende farmaceutiche, spesso riluttanti a impegnarsi. Il modo migliore per convincere questi colossi a tornare a fare antibiotici è un tema politico molto caldo, sia negli Stati Uniti sia in Europa, che sottende molti altri aspetti quali sovvenzioni, premi e brevetti.
Roberts – che ha tenuto in piedi “Swab e Send”, con una sovvenzione di 20.000 sterline, i suoi sostenitori e un’ostinata convinzione – sa quanto più efficace avrebbe potuto essere il suo progetto se avesse disposto di adeguati finziamenti: “Se avessi un sacco di soldi, potrei notevolmente migliorare la quantità di lavoro svolto, creando un team con tutte le competenze e la strumentazione necessarie. Tutti nello stesso posto, in condizioni di normalità accademica – Diciamo che tutto è solo un po’ più lungo di quanto dovrebbe essere».
Questo, però, succedeva un po’ di tempo fa.

https://www.youtube.com/watch?v=hKQiCDj84Mg
Oggi Roberts è stato reclutato dalla Scuola di Medicina Tropicale di Liverpool per lavorare a un impianto di 25 milioni di sterline che gli permetterà di fare proprio quello che aveva sognato: riunire diversi team di discipline scientifiche differenti per studiare nuovi antibiotici, portando con sé “Swab e Send”. Il progetto avrà un proprio budget, un nuovo laboratorio e nuove attrezzature. Ogni composto promettente potrà essere testato e sviluppato dai team che già lavorano all’interno della scuola. A chi gli chiede quante risorse occorrerebbero ad accelerare la ricerca di un nuovo farmaco risponde “Non abbiamo bisogno di uno o cinque nuovi farmaci, ma di mille, in modo che i medici possano dire: “In questo decennio ne stiamo usando 200, ma ne abbiamo pronti già altri 800 per quando questi non serviranno più”.
Adriana Paolini
Linkografia: