La rapida crescita della ricerca sulla medicina rigenerativa ha permesso lo sviluppo di una serie di nuovi approcci alle applicazioni dell’ingegneria tissutale. Fino a poco tempo fa, i principali punti di interesse della maggior parte degli studi erano la combinazione di diversi materiali per controllare il comportamento cellulare e l’utilizzo di diverse tecniche per ottimizzare la formazione dei tessuti, dal bioprinting 3D alla rigenerazione in situ. Tuttavia, con l’aumento della comprensione dei fondamenti dell’organizzazione cellulare, dello sviluppo e della rigenerazione dei tessuti, si è anche capito che per il prossimo passo nell’ingegneria tissutale è necessario un livello più elevato di controllo spazio-temporale sulle interazioni cellula-matrice. Si propone che la combinazione della ricerca sulle cellule artificiali con l’ingegneria dei tessuti possa fornire una via verso il controllo dello sviluppo di tessuti complessi. Dotando le cellule artificiali dei meccanismi alla base delle funzioni cellulari, come i meccanismi di comunicazione, il comportamento migratorio o il comportamento coerente delle cellule in base alle proprietà della matrice circostante, esse possono essere utilizzate per istruire le cellule native a seguire il comportamento differenziativo desiderato, con una risoluzione che non può essere raggiunta con i materiali della matrice tradizionale.
Le nuove sfide dell’ingegneria dei tessuti
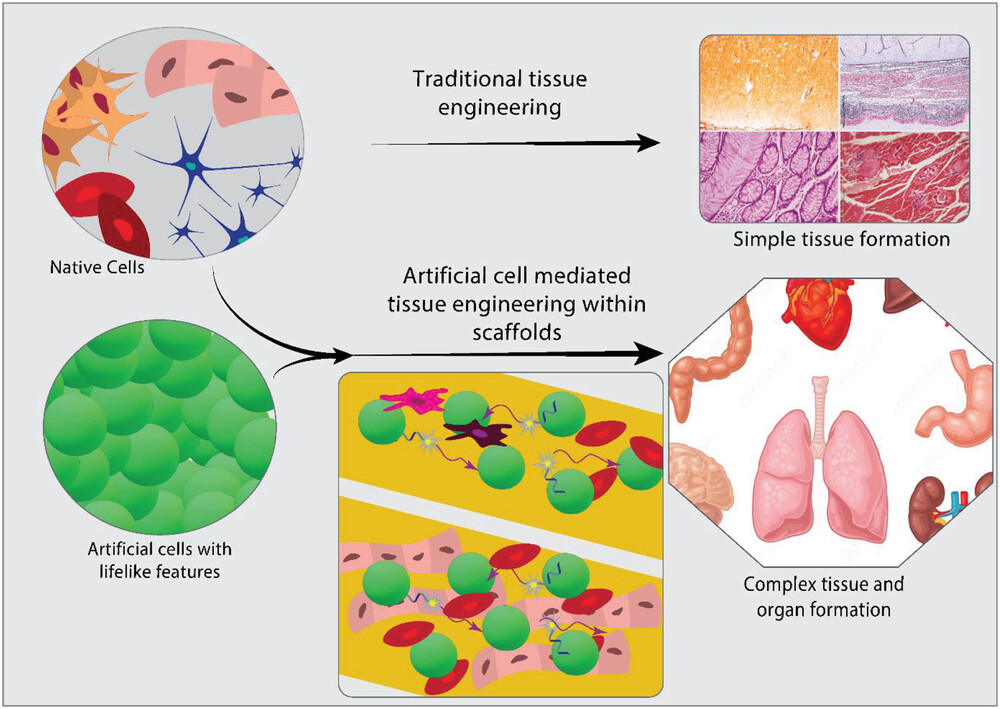
L’ingegneria dei tessuti mira a sviluppare materiali bioattivi per indurre la rigenerazione o la sostituzione di tessuti danneggiati. Sebbene gli approcci moderni abbiano iniziato a guadagnare slancio soprattutto negli ultimi 3 decenni, le radici delle applicazioni di ingegneria tissutale risalgono all’uso di innesti provenienti da diverse parti del corpo per la ricostruzione del naso nel XVI secolo nell’Italia rinascimentale, o addirittura di materiali estranei per sostituire parti del corpo mancanti, come l’uso del ferro come impianto dentale nelle comunità del I o del II secolo. Una migliore comprensione del processo di rigenerazione dei tessuti ha portato alla recente curva ripida per quanto riguarda lo sviluppo di nuove applicazioni e tecniche di ingegneria tissutale. Gran parte di questo sviluppo può essere ricondotto a una migliore comprensione della biologia cellulare e dello sviluppo, alla creazione di biomateriali o matrici più dinamiche che supportano la crescita dei tessuti e a un’ulteriore delucidazione dell’intricata interazione tra cellule e materiali della matrice. Sebbene siano stati compiuti molti progressi, è anche chiaro che con le tecniche attuali si incontrano dei limiti rispetto a ciò che l’ingegneria tissutale può offrire. Soprattutto per i tessuti complessi, composti da diversi tipi di cellule e con una microstruttura dettagliata, la ricreazione diventa complicata. Questo aspetto è ben compreso dal settore, che ha portato a una serie di metodi innovativi che forniscono un maggiore controllo spazio-temporale sulla differenziazione cellulare e sulla crescita dei tessuti. La medicina rigenerativa può inoltre trarre grande beneficio da uno sviluppo parallelo emerso nell’ultimo decennio, ovvero il campo della ricerca sulle cellule artificiali. In questo caso, l’attenzione si concentra sulla costruzione di compartimenti con caratteristiche simili alla vita, in grado di comunicare con l’ambiente e tra loro in modo ricco di informazioni e controllabile. Il potenziale di questa ricerca per il campo dell’ingegneria tissutale è tuttavia ancora poco esplorato. In questa prospettiva, discuteremo innanzitutto degli sviluppi nel campo dell’ingegneria tissutale che aiutano a controllare ulteriormente la rigenerazione dei tessuti. Descriveremo poi come l’ingegneria bottom-up di cellule artificiali potrebbe consentire una nuova direzione in questo campo, con prospettive entusiasmanti per il progresso della medicina rigenerativa (Figura 1).
Approcci convenzionali
Quando Langer e Vacanti coniarono il termine ingegneria tissutale nel 1993, descrissero il campo in cui i principi della biologia e dell’ingegneria si incontrano per fabbricare sostituti tissutali funzionali in 3D. Le strategie per lo sviluppo di un modello tissutale si basavano su un percorso consolidato che prevedeva l’isolamento delle cellule, l’aggiunta di sostanze biomolecolari e la semina delle cellule all’interno o su una matrice, seguita da una coltura in vitro per un certo periodo. Fin dalla fondazione di questo campo, i ricercatori si sono concentrati principalmente sullo sviluppo di nuove tecniche che permettano di modificare le caratteristiche chimiche e meccaniche dei materiali della matrice o di aggiungere spunti biomolecolari in modo controllato, per migliorare la capacità di creare un sostituto tissutale completamente funzionale. Soprattutto quest’ultimo argomento è impegnativo e di grande interesse per i tessuti complessi presenti, ad esempio, nel cervello o nei reni. Questi sono composti da diversi tipi di cellule che devono differenziarsi con un controllo spazio-temporale e quindi devono essere esposti a vari segnali biochimici che devono essere forniti localmente in un certo lasso di tempo alle cellule bersaglio corrette per un corretto sviluppo.
Gli approcci tradizionali all’ingegneria tissutale, in cui l’unità tissutale viene ingegnerizzata al di fuori dell’organismo, hanno una capacità limitata di creare matrici complesse che consentono la differenziazione e la proliferazione delle cellule nello stesso ambiente per periodi prolungati. Quando si utilizzano condizioni di coltura cellulare statiche, è impossibile ottenere un flusso omogeneo di ossigeno e nutrienti in tutta la struttura ingombrante ingegnerizzata. Per superare questo problema, sono stati sviluppati bioreattori progettati in modo esclusivo. Mohapatra et al, per esempio, hanno combinato un innesto ingegnerizzato composto da acido polilattico-co-glicolico (PLGA), fluoruro di polivinilidene e poli(N-vinilpirrolidone-co-glicidilmetacrilato) con un gel di fibrina per migliorare le condizioni del periodo di coltivazione del bioreattore. I loro risultati hanno mostrato che la maggiore stabilità strutturale dell’impalcatura ingegnerizzata aiuta a ridurre il periodo di condizionamento del bioreattore a giorni invece che a settimane.
Nonostante la riduzione del tempo di maturazione per lo sviluppo del tessuto tramite bioreattori, o addirittura la sostituzione della matrice biomateriale con materiali cellulari comprendenti più tipi di cellule, i sostituti dei tessuti ingegnerizzati in vitro faticano a replicare la funzionalità dei tessuti complessi quando si seguono gli approcci tradizionali. Una delle ragioni principali è l’elevato livello di stress a cui sono sottoposte le cellule durante il periodo di impianto o post-impianto. Un approccio promettente che segue la strategia tradizionale, ma evita l’impianto di scaffold cellularizzati in vitro, è l’ingegneria tissutale in situ. L’obiettivo principale di questo approccio è migliorare le capacità di rigenerazione endogena dell’organismo guidando le molecole di supporto e successivamente le cellule native verso la regione di interesse. Mentre molti ricercatori hanno seguito questa particolare strategia post-cellularizzando l’impalcatura impiantata all’interno dell’organismo, altri si sono concentrati sull’evitare la risposta immunogena per mantenere un periodo di maturazione sano. Uno studio interessante riportato da Tao et al. combina sia cellule autologhe che xenotrapianti. La loro applicazione mostra che l’innesto rivestito di membrana cellulare è stato riconosciuto come se fosse un innesto autologo, non inducendo quindi alcuna risposta immunitaria.
In generale, l’ingegneria tissutale in situ trae vantaggio dall’aggirare l’allestimento di un bioreattore, risolvendo molti problemi immunogenici. Tuttavia, manca ancora un controllo preciso del comportamento cellulare, grazie alle interazioni tra le cellule e le indicazioni biomolecolari e/o la matrice circostante. Questa attenta regolazione spazio-temporale dello sviluppo dei tessuti rimane una sfida significativa per il settore.
Tecniche di biofabbricazione
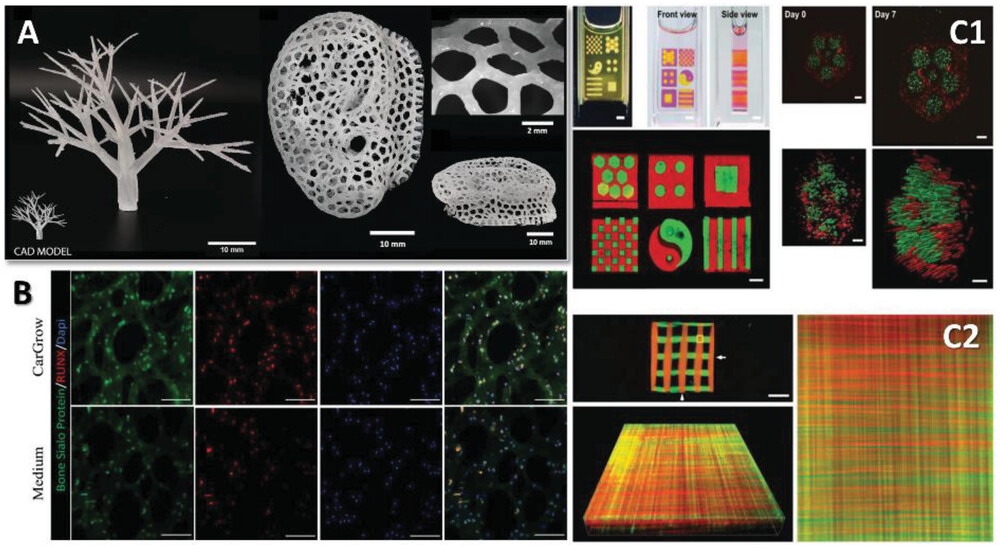
I metodi consolidati di ingegneria tissutale presentano limitazioni quando si cerca di rigenerare tipi di tessuto più complessi, a causa del limitato controllo spazio-temporale degli elementi biomolecolari e/o delle cellule incorporate nella struttura ingegnerizzata. Altre sfide che devono essere affrontate sono il miglioramento della risoluzione dei processi di fabbricazione e l’aumento della stabilità strutturale dei materiali utilizzati per la produzione di scaffold (Figura 2A). Inoltre, l’imitazione delle proprietà biologiche e strutturali dell’ambiente extracellulare (Figura 2B) e la co-coltura di diversi tipi di cellule nello stesso ambiente sono problemi non banali da risolvere (Figura 2C). Oltre a queste sfide tecniche, prima di poter realizzare applicazioni cliniche è necessario prendere in seria considerazione anche gli aspetti etici relativi alla raccolta di cellule staminali da fonti specifiche e all’utilizzo di animali per esperimenti in vivo.
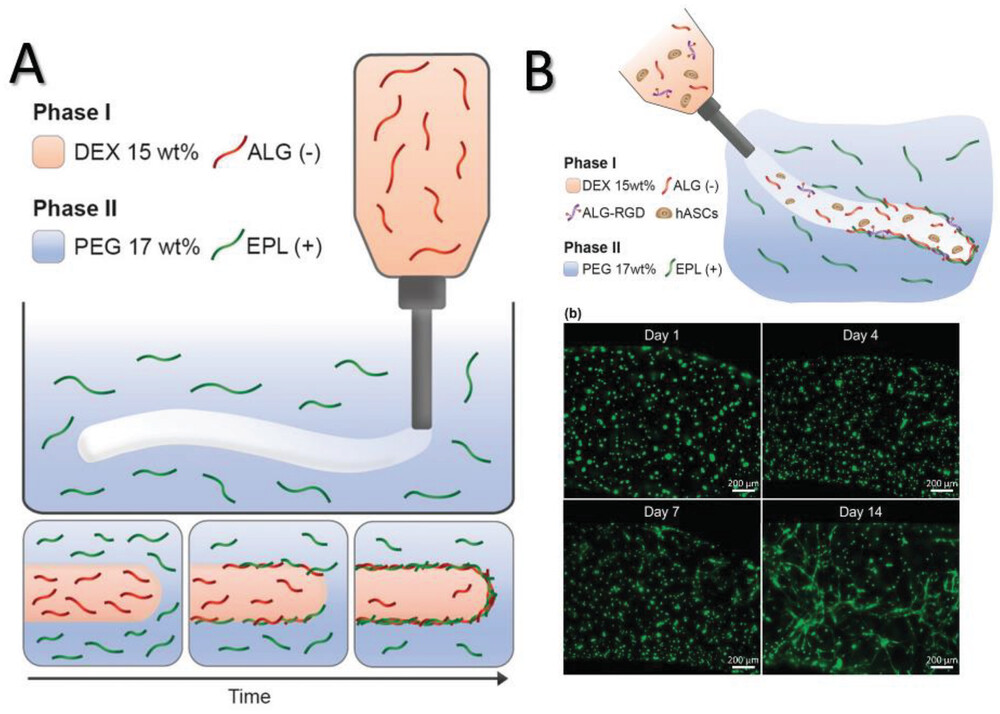
Molti ricercatori hanno sviluppato tecniche nuove e/o migliorate per superare alcuni di questi problemi nel contesto di un particolare metodo di fabbricazione o combinando metodi diversi. Ad esempio, Liu et al. hanno sviluppato il cosiddetto metodo di biofabbricazione Filament Light (Flight) per ottenere un migliore controllo sull’allineamento dei filamenti per una migliore guida cellulare, per affrontare l’importanza del controllo spazio-temporale per lo sviluppo di tessuti complessi. Gonçalves et al, invece, si sono concentrati sullo sviluppo di una nuova tecnica per poter utilizzare combinazioni di bioinchiostri considerate non stampabili, seguendo un approccio di separazione di fase in sistemi liquido-liquido (Figura 3). Sfruttando la separazione di fase tra polimeri di carica opposta, sono riusciti a eliminare la necessità di materiali di supporto strutturale per le combinazioni non stampabili. Allo stesso modo, Zhang et al. hanno riportato un metodo che richiede una singola gocciolina per avviare un processo di fabbricazione basato sulla luce all’interno di un ambiente di resina a base di poliacrilato, con conseguente riduzione dei tempi di produzione. Questi studi, insieme a molti altri, mostrano l’obiettivo comune di migliorare le proprietà strutturali dei modelli ingegnerizzati, tenendo conto dei limiti di risoluzione e, allo stesso tempo, di fornire migliori proprietà di matrice per la maturazione dei tessuti.
Sebbene l’attenzione delle strutture di ingegneria tissutale si concentri sui processi di fabbricazione e sulla successiva rigenerazione dei tessuti nell’area interessata, i modelli di tessuto ingegnerizzato possono essere utili anche per altri campi correlati, come la modellazione delle malattie o la somministrazione controllata di farmaci o biomolecole. Gli studi di modellazione delle malattie si differenziano dai modelli di tessuto sano ingegnerizzato per l’utilizzo di diversi tipi di cellule e/o agenti che inducono la malattia. [Gli studi sulla somministrazione controllata si concentrano principalmente sull’incorporazione di nano/microparticelle che trasportano il carico nei biomateriali. È interessante notare che questo approccio è stato recentemente introdotto anche nelle applicazioni tradizionali dell’ingegneria tissutale per la somministrazione controllata di segnali biologici e per migliorare il controllo sul destino delle cellule staminali, il che ha dato vita a un nuovo campo denominato ingegneria tissutale assistita da particelle.
Ingegneria tissutale assistita da particelle
Il controllo preciso del posizionamento di nano/microparticelle nelle impalcature dei tessuti ingegnerizzati consente l’induzione spazialmente controllata di diversi comportamenti cellulari in diverse regioni del materiale della matrice. Inoltre, la possibilità di distribuire diverse popolazioni cellulari insieme a nano/microparticelle in regioni specifiche delle impalcature consentirebbe di fabbricare tessuti ibridi in grado di imitare organi complessi in modo migliore rispetto all’attuale stato dell’arte. Esiste una varietà di vettori di carico utilizzati nelle applicazioni tradizionali dell’ingegneria tissutale; esosomi, liposomi, micelle e nanoparticelle inorganiche sono stati sfruttati soprattutto per la loro funzione di serbatoio. Sono stati utilizzati per innescare la rigenerazione osteogenica, per mantenere l’adesione cellulare, e per indurre la rigenerazione del tessuto cardiaco oltre alle loro capacità di veicolazione mirata. Un approccio interessante che segue una strategia di ingegneria assistita da particelle impiega particelle separate in fase invece di nano-microparticelle incorporate in biomateriali. In particolare, la loro superiore permeabilità le rende ideali per applicazioni avanzate di biologia cellulare e ingegneria tissutale.
Tuttavia, la maggior parte degli approcci all’ingegneria tissutale basati sulle particelle soffre di un controllo temporale limitato e raramente sono interattivi con le cellule nel loro ambiente, nonostante i meccanismi di rilascio avanzati. Pertanto, per sviluppare approcci più avanzati all’ingegneria tissutale, sono necessari sistemi più intelligenti che possano imitare meglio le funzioni extra e intracellulari. Sistemi che permettano la comunicazione tra diverse popolazioni cellulari e la matrice extracellulare o che consistano in particelle mobili in grado di interagire con l’ambiente circostante e con le popolazioni cellulari vicine attraverso la somministrazione spazio-temporale di biomolecole porterebbero a migliori capacità di ingegneria tissutale. Un campo emergente che mira a raggiungere queste caratteristiche è la ricerca sulle cellule artificiali, in cui vengono indotte proprietà interattive e intelligenti utilizzando particelle sintetiche che imitano le cellule.
Ingegneria tissutale mediata da cellule artificiali
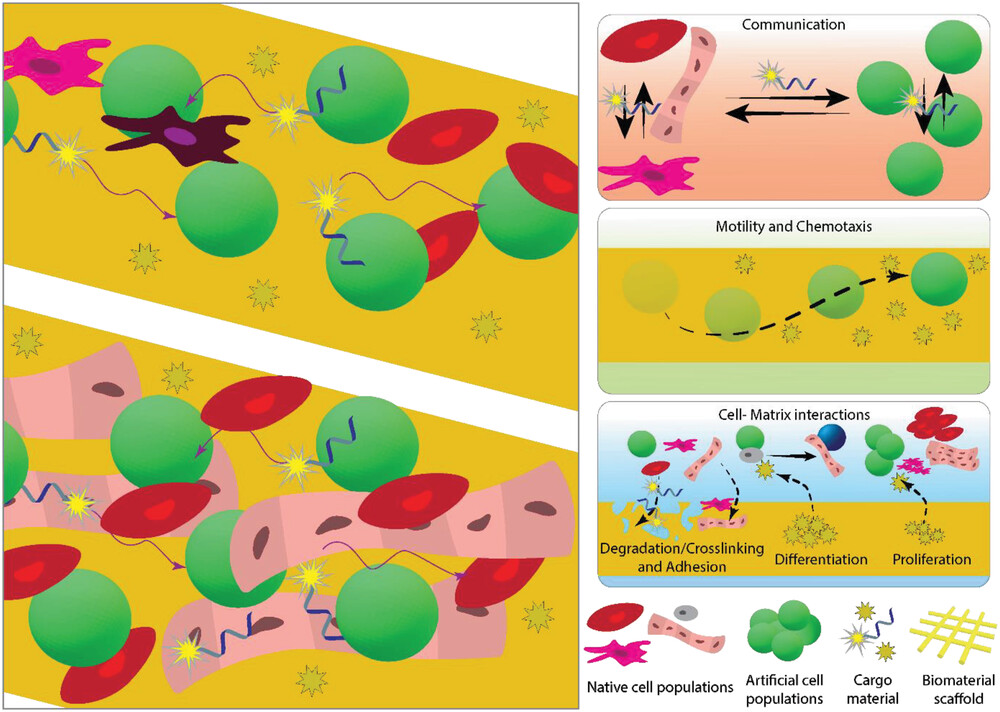
L’ingegneria tissutale mediata da cellule artificiali sfrutta le cellule artificiali per fabbricare tessuti ibridi o completamente sintetici, combinandole con gli approcci tradizionali di ingegneria tissutale. Le cellule artificiali possono avere una moltitudine di interazioni con le popolazioni cellulari native e tra di loro. Possono comunicare tra loro e/o con le cellule native in modo controllato attraverso la somministrazione e il sequestro di piccole molecole; possono spostarsi verso un bersaglio utilizzando funzioni interne e/o gradienti esterni; oppure possono interagire con la matrice circostante e con le molecole di innesco all’interno della matrice che possono determinare vari eventi come la differenziazione e/o la proliferazione delle cellule (Figura 4).
Modelli di cellule artificiali
Le cellule artificiali sono particelle discrete, di dimensioni cellulari, autoassemblate e capaci di funzioni cellulari dinamiche di base, come le interazioni stimolo-reattive con l’ambiente circostante. La ricerca sulle cellule artificiali è stata avviata per esplorare fino a che punto possiamo spingere l’autoassemblaggio molecolare dal basso verso l’alto per creare sistemi con proprietà simili alla vita da un punto di vista fondamentale. Questo approccio è anche collegato alla ricerca sulle protocellule, che getta luce sugli eventi che hanno portato all’origine della vita sulla Terra. Sebbene finora non sia stato possibile sviluppare cellule artificiali completamente funzionanti, esse sono state costruite in modo tale da poter dimostrare una comunicazione rudimentale con l’ambiente e con le cellule viventi. Queste caratteristiche interattive sono di grande interesse anche per affrontare alcune delle sfide ancora aperte menzionate in precedenza nell’ambito dell’ingegneria dei tessuti. In questa sezione, descriveremo i primi approcci a come le cellule artificiali possono essere integrate nei tessuti artificiali e come queste attività potrebbero essere estese all’ingegneria tissutale per fornire un ambiente più personalizzato per il comportamento cellulare.
Sono stati sviluppati molti compartimenti diversi che possono essere utilizzati come cellule artificiali. Più comunemente, sono state utilizzate vescicole unilamellari giganti (GUV), la cui membrana bilayer fosfolipidica mostra una grande somiglianza con la membrana di una cellula vivente. Un altro sistema spesso studiato è quello basato sui coacervati. I coacervati si formano dalla separazione di fase spontanea di componenti inizialmente solubili in acqua in una fase acquosa ricca di componenti e una povera di componenti. Può trattarsi, ad esempio, di un coacervato complesso ottenuto mescolando due polimeri con carica opposta. L’interesse per i coacervati deriva dalla loro natura affollata, che mostra una somiglianza con la densità del citoplasma delle cellule viventi. Nel corso degli anni, diverse caratteristiche simili alla vita sono state incorporate in piattaforme cellulari artificiali in modo modulare, come la conversione energetica e il metabolismo, la crescita e la divisione, il comportamento adattivo e l’elaborazione delle informazioni. Sebbene non sia ancora stata raggiunta la piena integrazione di tutte le diverse funzioni, questi singoli moduli aprono interessanti possibilità di applicazione nell’ingegneria dei tessuti. Slootbeek et al. hanno riferito che i coacervati possono essere utilizzati come modello adeguato per studiare le caratteristiche di base della proliferazione cellulare, come la crescita, la replicazione e la divisione durante il loro ciclo di maturazione. Il nostro gruppo ha recentemente sviluppato sistemi cellulari artificiali a base di coacervati stabilizzati con terpolimeri con una serie di caratteristiche biomimetiche. Uno dei nostri studi, condotto da Song et al., ha dotato i coacervati di motilità attaccando enzimi alla membrana flessibile che stabilizzava le particelle di coacervato. La motilità era basata su un processo di movimento stocastico ispirato alla natura. In un altro studio su cellule artificiali basate su coacervati condotto dal nostro gruppo, van Stevendaal e Mashima et al. hanno dimostrato che il trasporto diretto di proteine da una popolazione di coacervati all’altra, utilizzando un meccanismo di assorbimento e rilascio controllato mediato dal DNA, era fattibile, ricordando la comunicazione endocrina. Son et al. hanno utilizzato soluzioni proteiche geneticamente ingegnerizzate stabilizzate con un rivestimento lipidico come modello cellulare artificiale e hanno studiato la capacità di sequestro delle biomolecole del loro modello. Il loro meccanismo di assorbimento delle biomolecole mediato dall’acido nichel-trinitriloacetico ha offerto un’elevata selettività e, grazie al denso ambiente di condensazione delle proteine, sono riusciti a mantenere una maggiore stabilità. Zahn et al. hanno utilizzato come modello una vescicola lipidica gigante unilamellare incorporata in un citoscheletro a base di acidi nucleici. Le loro variazioni programmabili dei filamenti di DNA hanno creato un citoscheletro di DNA auto-assemblato all’interno della vescicola, innescato dall’ATP, che è stato poi utilizzato per la consegna del carico attraverso vescicole più piccole che sono state intrappolate nella GUV. Sebbene gli approcci all’ingegneria cellulare artificiale tendano a utilizzare materiali completamente sintetici, un interessante studio di Xu et al. ha utilizzato cellule viventi per fabbricare il loro modello di cellula artificiale. Il loro modello comprendeva (componenti di) cellule di Escherichia coli e Pseudomonas aeruginosa per creare una cellula artificiale con una struttura interna, una fornitura di energia e una capacità di elaborazione delle informazioni molto elevate. Utilizzando costrutti ibridi di cellule viventi/sintetiche si possono ottenere modelli cellulari più complessi. Nel complesso, l’attuale cellula artificiale all’avanguardia può essere considerata un contenitore biocompatibile di dimensioni cellulari in grado di svolgere un’ampia varietà di funzioni biomimetiche reattive agli stimoli, come l’espressione genica, la motilità autonoma, il caricamento e il rilascio di carichi e la comunicazione chimica derivata da piccole molecole, che potrebbero essere utili nelle applicazioni di ingegneria tissutale.
Nonostante i diversi tipi di ricerca sulle cellule artificiali, queste presentano ancora alcuni svantaggi rispetto alle cellule naturali quando si considera l’utilizzo di cellule artificiali per studi di ingegneria tissutale. La loro minore complessità intrinseca rende difficile imitare l’affollata composizione delle cellule naturali.
Tessuti artificiali
Sebbene la maggior parte delle attività di ricerca sulle cellule artificiali si concentri sul comportamento di una singola cellula, di recente sono stati sviluppati modelli multicellulari per studiare la relazione tra diverse entità cellulari. Smith et al. hanno mostrato una rete di comunicazione tra cellule artificiali basate su vescicole lipidiche e cellule batteriche attraverso l’attivazione della luce. I loro risultati hanno mostrato un controllo spazio-temporale sull’espressione genica all’interno delle cellule artificiali, con diverse popolazioni cellulari attivate utilizzando diverse lunghezze d’onda. Analogamente, Zhang et al. hanno riportato una rete interattiva tra cellule artificiali basate su coacervato e cellule tumorali del fegato umano. Il loro meccanismo si basa sul danno indotto dalle specie reattive dell’ossigeno attraverso una via di comunicazione guidata dalla glucosio ossidasi. Inoltre, con l’aggiunta dell’enzima catalasi per la regolazione del danno alla popolazione di cellule tumorali, l’effetto distruttivo delle specie reattive dell’ossigeno è stato limitato. Infine, hanno ipotizzato che le goccioline a base di coacervato possano essere utilizzate come modelli di organuli senza membrana quando vengono incorporate in cellule reali. Wang et al. hanno utilizzato cellule artificiali basate su vescicole lipidiche in grado di interagire con le cellule batteriche, pur utilizzando una rete di comunicazione simile guidata dagli enzimi. Grazie alla loro membrana lipidica modificata con melittina, le cellule artificiali contenenti glucosio ossidasi o rafano perossidasi hanno interagito tra loro e con le entità circostanti. Lo stesso meccanismo si applica alle cellule artificiali contenenti isopropil β-d-tiogalattoside per inviare o ricevere segnali da/verso le cellule batteriche.
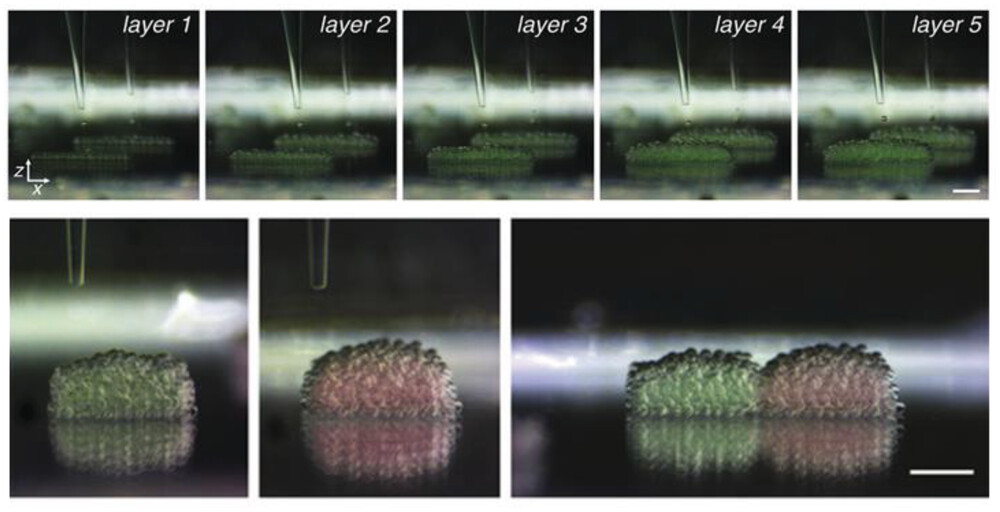
Negli esempi sopra descritti, l’attenzione si concentra sull’imitazione del comportamento delle popolazioni cellulari piuttosto che sulla creazione di tessuti artificiali. Un esempio sofisticato di quest’ultima categoria è descritto da Alcinesio et al. che hanno utilizzato modelli di cellule artificiali a base di acqua e olio per fabbricare tessuti sintetici, come si vede nella Figura 5. Stampando in 3D singole cellule in moduli multicellulari che possono interagire tra loro attraverso una varietà di meccanismi, a seconda del modello cellulare artificiale utilizzato, le loro strutture assemblate sono riuscite a mostrare semplici proprietà simili a quelle dei tessuti. Un altro affascinante studio verso un modello di tessuto completamente sintetico è stato sviluppato da Gobbo et al. che hanno utilizzato un approccio di chimica bio-ortogonale per modificare la membrana cellulare artificiale, portando a cellule artificiali interagenti basate su proteinosomi. Introducendo gruppi azide o biciclo nonyne (BCN) in diverse popolazioni di superfici di polimersomi funzionalizzati con poli(N-isopropilacrilammide-acido metacrilico), sono riusciti ad assemblare diverse popolazioni di polimersomi in strutture sferoidi. Nello stesso contesto, Li et al. hanno utilizzato vescicole a base lipidica per fabbricare modelli di prototessuti artificiali mediante un approccio di assemblaggio guidato dal campo magnetico. Le loro GUV paramagnetiche contenenti MnCl2 o gadobutrolo sono state distribuite spazialmente su una rete di acciaio inossidabile, dove il campo magnetico applicato ha influenzato le particelle attraverso le griglie della rete. Liu et al. hanno utilizzato cellule artificiali a base di coacervati stabilizzati con lipidi per creare strutture tubolari che assomigliano alla vascolarizzazione. Hanno preparato coacervati a base di dioleoil-fosfatidilcolina (DOPC) stabilizzati con poli (cloruro di diallildimetile ammonio) (PDDA) e DNA a doppio filamento tramite separazione di fase liquido-liquido in ambiente acquoso. Successivamente, per modulare la produzione di ossido nitrico come sistema modello per le loro cellule artificiali, hanno modificato le membrane di diverse popolazioni di coacervati con glucosio ossidasi, perossidasi di rafano o catalasi, con una successiva fase di assemblaggio delle popolazioni in una struttura tubolare in cui il glucosio/idrossiurea era l’input per la reazione modello. Wang et al. hanno riportato assemblaggi di fosfolipidi in strutture tubolari, coniche, sferiche o cisternali impilate come modelli cellulari artificiali per fabbricare tessuti artificiali, e Galanti et al. hanno seguito un approccio di stampaggio per creare cellule artificiali assemblate, modificando la membrana cellulare tramite la chimica bio-ortogonale per favorire il comportamento di accumulo. Hanno assemblato diverse popolazioni di proteinosomi modificati con azide e BCN utilizzando uno stampo in poli(tetrafluoroetilene) (PTFE) che galleggia su una soluzione di polisorbato. I proteinosomi sono stati assemblati attraverso la locomozione sinergica del galleggiamento e del flusso di Marangoni all’interno delle griglie vuote dello stampo. Modificando la forma e le dimensioni dello stampo, si è riusciti a controllare la struttura del tessuto assemblato.
Sia che il tessuto artificiale sia costituito solo da cellule artificiali o sia da cellule artificiali e cellule native, tutti gli studi si sono concentrati su un obiettivo simile: imitare il comportamento cellulare e/o le dinamiche simili a quelle dei tessuti. Questo obiettivo può essere raggiunto creando una rete di comunicazione interattiva attraverso meccanismi di assorbimento/rilascio controllati e modulando le popolazioni cellulari mobili per indurre la migrazione cellulare per la rigenerazione dei tessuti. Inoltre, la fabbricazione di un citoscheletro può aiutare a mimare la divisione cellulare e l’integrazione di organelli artificiali tramite compartimentazione può essere impiegata per mimare la differenziazione cellulare. Combinando e/o confrontando queste caratteristiche con i processi di ingegneria tissutale si potrebbe ottenere un miglioramento del periodo di rigenerazione. Ciò è possibile grazie alle proprietà controllabili dell’approccio mediato dalle cellule artificiali, come la regolazione delle proprietà strutturali dell’impalcatura tramite la motilità cellulare o l’ottimizzazione dei gradienti dei componenti biochimici tramite reti di comunicazione interattive. Un’ampia scelta di biomateriali da utilizzare negli studi di ingegneria tissutale offre anche molte opportunità per approcci mediati da cellule artificiali, con un maggiore controllo sulle proprietà fisico-chimiche delle unità ingegnerizzate all’interno. Nello stesso contesto, uno dei limiti degli attuali approcci a mediazione cellulare artificiale è la mancanza di integrità strutturale delle unità sintetiche ingegnerizzate quando non è stato coinvolto alcun elemento di supporto nel modello di tessuto. Le popolazioni di cellule native possono formare sferoidi, organoidi o assemblaggi con proprietà strutturali in qualche misura definite, mentre i modelli di tessuto artificiale devono affrontare problemi di mantenimento delle caratteristiche meccaniche delle singole cellule artificiali.
La prospettiva dell’ingegneria tissutale mediata da cellule artificiali
Quando ci concentriamo sui costituenti necessari a livello cellulare per la rigenerazione di tessuti e organi in un approccio di ingegneria tissutale, possiamo restringere la complessa e dinamica catena di eventi a tre aspetti principali dal punto di vista dell’interazione cellulare. Queste interazioni possono avvenire tra le cellule, tra le cellule e i componenti della matrice extracellulare circostante, e tra le cellule e le molecole estranee che non fanno parte della matrice extracellulare nativa.
L’utilizzo di biomateriali naturali per l’ingegneria tissutale per imitare questi eventi naturali è ancora una sfida, poiché gli approcci ingegneristici bottom-up possono non riuscire a replicare le funzionalità complesse richieste. L’applicazione di strumenti di biologia sintetica che operano secondo i paradigmi del rilevamento, dell’elaborazione e della risposta, come i sistemi di espressione proteica senza cellule o i circuiti genetici, in cui diverse popolazioni possono comunicare tra loro per ingegnerizzare i componenti di base dei meccanismi di rigenerazione, può essere una buona tecnica alternativa per ottenere risultati riproducibili per comprendere meglio e imitare gli eventi naturali. A questo proposito, le cellule artificiali hanno molto da offrire per raggiungere un livello più elevato di controllo sulla maturazione dei tessuti. Sono state sviluppate a tal punto da poter comunicare in modo reattivo con le cellule native, ad esempio attraverso il rilascio di fattori di crescita. Possono essere utilizzate come semplice serbatoio, ma l’inclusione di macchinari di trascrizione e traduzione privi di cellule consentirebbe loro di produrre attivamente componenti bioattivi. Alcune cellule artificiali sono dotate di una robustezza che dovrebbe renderle bioprinabili, il che consentirebbe il loro posizionamento localizzato. La loro mancanza di potenziale di replicazione non è inoltre un problema, poiché la loro funzione è transitoria e necessaria solo fino alla ricrescita del tessuto nativo. Oltre alle interazioni dirette cellula-cellula, ingegnerizzando meccanismi naturali e/o sintetici in materiali simili ai tessuti, si potrebbe anche esplorare il ruolo della matrice extracellulare nativa per dirigere le interazioni tra le cellule e/o l’ambiente circostante utilizzando elementi naturali o sintetici, oppure si possono usare entità simili alle cellule per imitare le funzioni cellulari. Tramite questi approcci dovrebbe essere possibile in futuro fabbricare dinamiche tissutali complesse attraverso le interazioni tra unità intelligenti sintetiche ed elementi naturali. Grazie alla loro natura durevole, gli elementi sintetici potrebbero essere utilizzati anche per le tecniche di ingegneria tissutale che prevedono campi elettrici o ad alta pressione durante il processo di fabbricazione della matrice, normalmente non compatibili con le cellule viventi.
La maggior parte delle opportunità sopra menzionate non sono ancora state realizzate, ma il modo in cui questi due campi – la ricerca sulle cellule artificiali e l’ingegneria dei tessuti – si stanno sviluppando, ci fa pensare che nel prossimo futuro si verificherà probabilmente una convergenza. La combinazione di strumenti per le cellule artificiali e i tessuti con le applicazioni tradizionali dell’ingegneria tissutale può aprire la strada alla fabbricazione di tessuti ibridi che offrono un sistema più affidabile per il controllo del comportamento cellulare in modelli ingegnerizzati.
Biografie degli autori della pubblicazione
Yiğitcan Sümbelli ha conseguito il Master in Biochimica presso l’Università di Anadolu nel 2019. Durante i suoi studi, ha lavorato allo sviluppo di una nuova combinazione di bioinchiostri per potenziali studi di ingegneria dei tessuti neurali, con un interesse specifico per l’approccio di bioprinting 3D basato sull’estrusione, sotto la supervisione del Prof. Sibel Emir Diltemiz e del Prof. Arzu Ersöz. Attualmente è candidato al dottorato di ricerca nel gruppo di van Hest e lavora all’implementazione di sistemi cellulari artificiali a base di coacervato per applicazioni di ingegneria tissutale 3D sotto la supervisione del Dr. Alexander F. Mason e del Prof. Jan van Hest.
Alexander F. Mason ha conseguito il dottorato di ricerca in Chimica presso la University of New South Wales nel 2017. La sua tesi era incentrata sullo sviluppo di vescicole di copolimeri a blocchi come impalcature cellulari sintetiche. Durante il suo primo post-dottorato nel laboratorio di van Hest, si è dedicato alle cellule sintetiche a base di coacervato e alla loro applicazione a sistemi auto-assemblati gerarchicamente di dimensioni cellulari.
Jan van Hest ha conseguito il dottorato di ricerca presso l’Università di Tecnologia di Eindhoven (1996) in Chimica macro-organica con il Prof. E. W. Meijer. Ha lavorato come postdoc con il Prof. D. A. Tirrell sull’ingegneria delle proteine. Nel 2000 è stato nominato professore ordinario di Chimica bio-organica presso la Radboud University Nijmegen. Da settembre 2016 è titolare della cattedra di Chimica bio-organica presso la Eindhoven University of Technology. Da maggio 2017 è direttore scientifico dell’ICMS. L’obiettivo del gruppo è sviluppare compartimenti ben definiti per la nanomedicina e la ricerca sulle cellule artificiali.
Traduzione a cura della Redazione
pubblicazione originale: https://onlinelibrary.wiley.com/doi/10.1002/adbi.202300149