Nuovi farmaci controllano la morte cellulare programmata
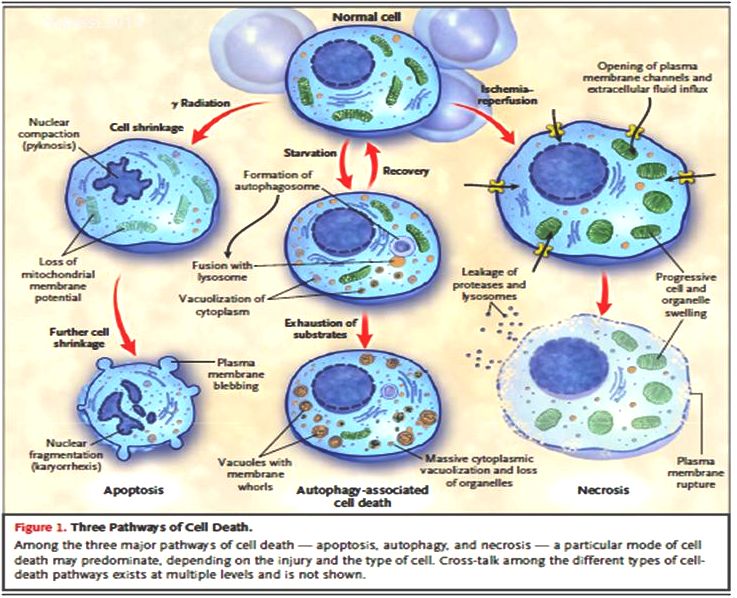
La morte cellulare deregolata è un elemento caratteristico di molte malattie, dall’infiammazione alla lesione ischemica dei tessuti, causata da un approvvigionamento limitato di ossigeno. Un metodo innovativo che quantifica i processi di morte nelle cellule contribuirà a progettare nuovi farmaci per controllare queste patologie.
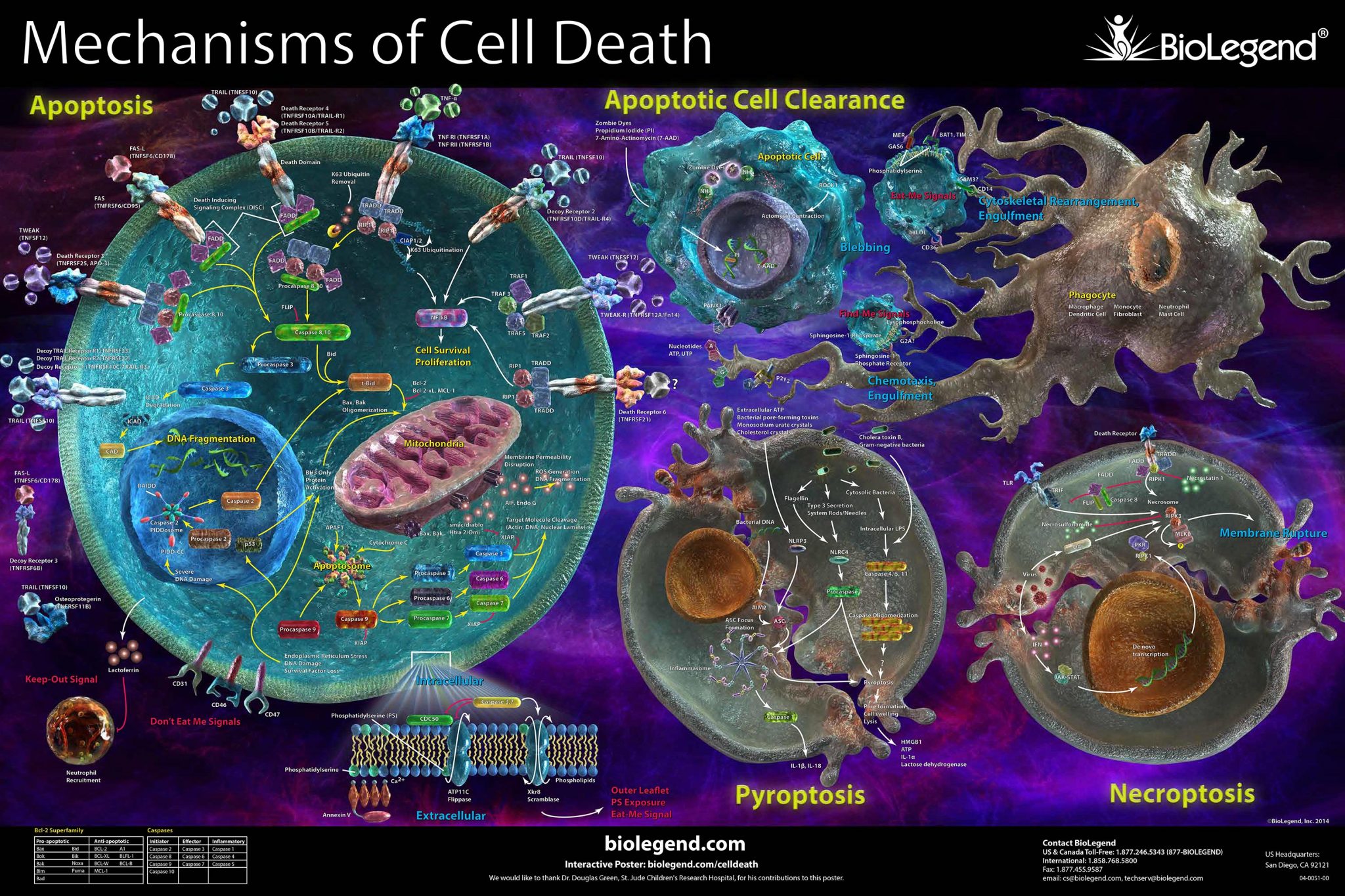
Durante la morte cellulare programmata (Programmed Cell Death, PCD), la formazione di specifici complessi proteici attiva percorsi distinti all’interno delle cellule. L’inibizione dell’attività di alcuni di questi complessi proteici attraverso piccole molecole può ridurre i danni associati alle malattie e dimostrare efficacia terapeutica. Tuttavia, gli sforzi indirizzati alla scoperta dei farmaci sono stati ostacolati dalla mancanza di strumenti e saggi che misurino la formazione dei complessi.
Saggi innovativi per lo screening dei complessi proteici della PDC
Il progetto EPIC, con il supporto del programma Marie Skłodowska-Curie, ha affrontato questi problemi tecnologici e sviluppato nuovi approcci per lo screening dei complessi proteici della PCD. «La delineazione dei meccanismi di PCD agevolerà lo sviluppo di piccole molecole in grado di attivare o disattivare i complessi proteici in base alle condizioni», spiega Howard Fearnhead, borsista di ricerca Marie Skłodowska-Curie. Il team del progetto era multidisciplinare e ha coinvolto esperti nel campo della morte cellulare, della farmacologia e dello screening, della biologia strutturale e della chimica dei prodotti naturali.
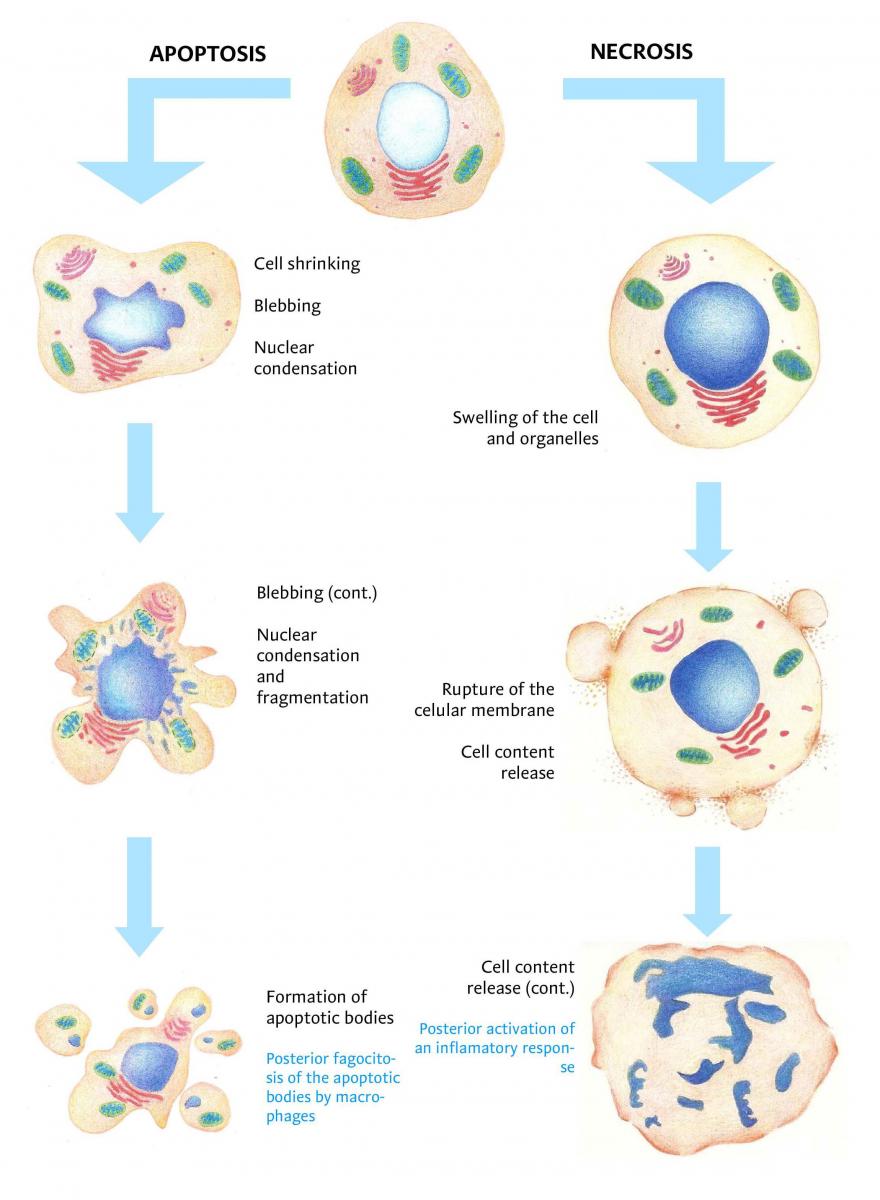
La ricerca si è concentrata sull’apoptosi, un approccio di PCD attivato dallo stress mitocondriale o dai danni cellulari che implica il rilascio della proteina mitocondriale citocromo c. Questa proteina induce l’autoassociazione del fattore di attivazione delle proteasi apoptotiche 1 (Apaf-1) che, assieme alla proteasi caspasi 9, attiva il processo di uccisione cellulare.
Inoltre, gli scienziati hanno studiato un altro meccanismo di PCD, la necroptosi, attivata in risposta al fattore di necrosi tumorale, ai farmaci antitumorali e ai patogeni. La necroptosi implica l’oligomerizzazione della proteina del dominio chinasi del lignaggio misto (MLKL) avviata dalle protein-chinasi che interagiscono con il recettore, condizionando la permeabilità della membrana e causando la morte cellulare necrotica.
Piccole molecole che intervengono sulla PCD
Secondo Fearnhead, «gli attivatori di Apaf-1 possiedono il potenziale per funzionare come agenti antitumorali, ma tali molecole hanno ricevuto scarsa attenzione a causa della mancanza di saggi che misurino l’attività di Apaf-1». EPIC ha colmato questo divario attraverso lo sviluppo di un saggio in grado di rilevare la funzione e l’interazione proteica nel complesso apoptotico, o apoptosoma. La reazione produce luminescenza con l’interazione proteica, rilevata da un biosensore appositamente progettato.
Allo stesso modo, EPIC ha costruito e convalidato un biosensore per individuare l’interazione delle proteine del necrosoma. Ciò si rivelerà estremamente utile per l’identificazione e la verifica di piccole molecole inibitrici della necroptosi in grado di proteggere da lesioni associate all’ischemia, neurodegenerazione e nefrotossicità indotta dalla chemioterapia.
I nuovi strumenti sperimentali del team di EPIC hanno aiutato gli scienziati a chiarire il meccanismo di azione e determinare i siti di legame di due piccole molecole precedentemente identificate. Essi hanno inoltre scoperto un nuovo inibitore di complessi proteici, proveniente da un organismo di acque profonde, non descritto in precedenza, raccolto dal fondale dell’Atlantico settentrionale, e chiarito la sua struttura chimica.
Prospettive future
Gli strumenti ad alta produttività di EPIC saranno sfruttati per la scoperta farmacologica, al fine di caratterizzare le proprietà farmacologiche degli inibitori di complessi proteici che inducono la morte cellulare. L’utilizzo di questi strumenti per lo screening di grandi librerie chimiche culminerà nell’identificazione di nuove molecole primarie.
«I passi successivi consistono nell’estendere le applicazioni dei saggi per visualizzare i complessi proteici in cellule e tessuti in vivo», prosegue Fearnhead. I ricercatori di EPIC stanno lavorando per raggiungere questi obiettivi attraverso la collaborazione con esperti ricercatori di farmacologica nei Paesi Bassi, biologi dello sviluppo in Spagna e Norvegia ed esperti nella visualizzazione della luminescenza in Svizzera e Giappone.